年
九年级
化学
制定日
课型
复习课
级
期
课
物质的构
主备人
执教人
使用时
题
成
间
知识与技能
1.掌握分子(原子)的性质
目标
2.认识分子与原子,学会从微观角度分析物质的变化
教
学
过程与方法
掌握运用化学知识解决实际问题的能力。
目
目标
标
在学习中感受宏观与微观的联系
情感态度与
价值观
教学重点
物质的微观构成
教学难点
宏观变化与微观结构间的联系
个人修
一、考点梳理
订
复习方式:自主复习记忆(回归课本)
一。考点梳理
考点1分子和原子
1.分子和原子的区别和联系
分子
原子
由分子构成的物质,分子是保持物」原子是
变化中的最小粒
概念
质性质的最小粒子
子
①都是构成物质的基本粒子;②质量和体积都很
;③都在不停
相同点
地,
—;④粒子间都有一定的
区别
在化学变化中分子一再分
在化学变化中原子
—再分
联系
分子、原子都是构成物质的粒子;分子是由
构成的
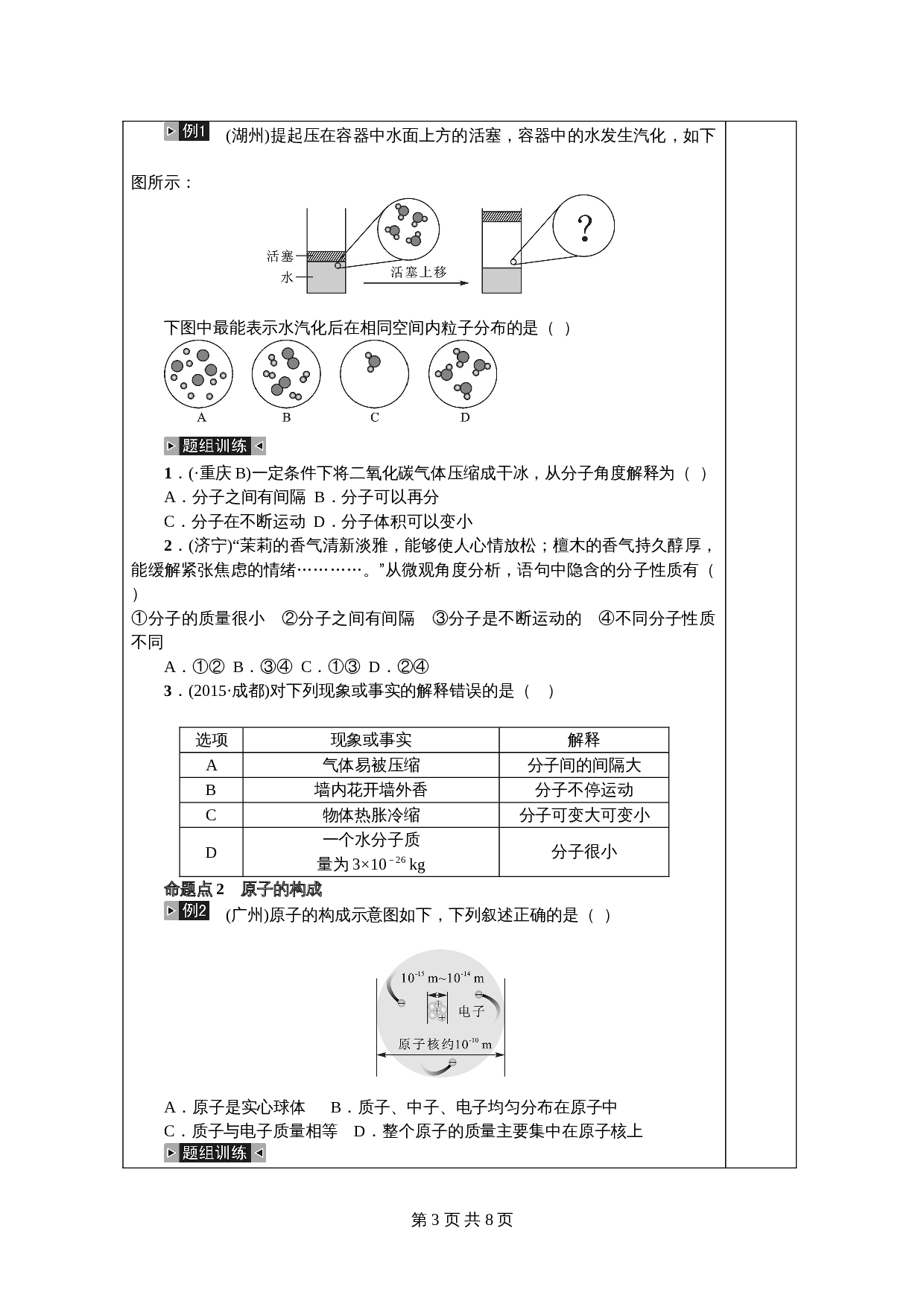
2.用分子、原子观点解释物质的变化
(1)物理变化:构成物质的分子
变成其他分子。如水变成水蒸气只是水分子
的_
发生了变化。
(2)化学变化:构成物质的
破裂为
重新组合成新的
考点2原子的构成
由于原子核内质子所带电荷和核外电子的电荷
相等、且
相反,因
此,整个原子不显电性。
【温馨提示】(1)原子核不一定有中子,如氢原子核内无中子。
(2)在原子中,核电荷数=质子数=核外电子数。
考点3核外电子排布
第1页共8页
1.核外电子排布的初步知识
(1)通常用电子层表明运动着的电子离核远近的不同。
(2)元素原子核外电子最少的有层,最多的有7层,最外层电子最多不超过
个。(只有1层的不超过2个)
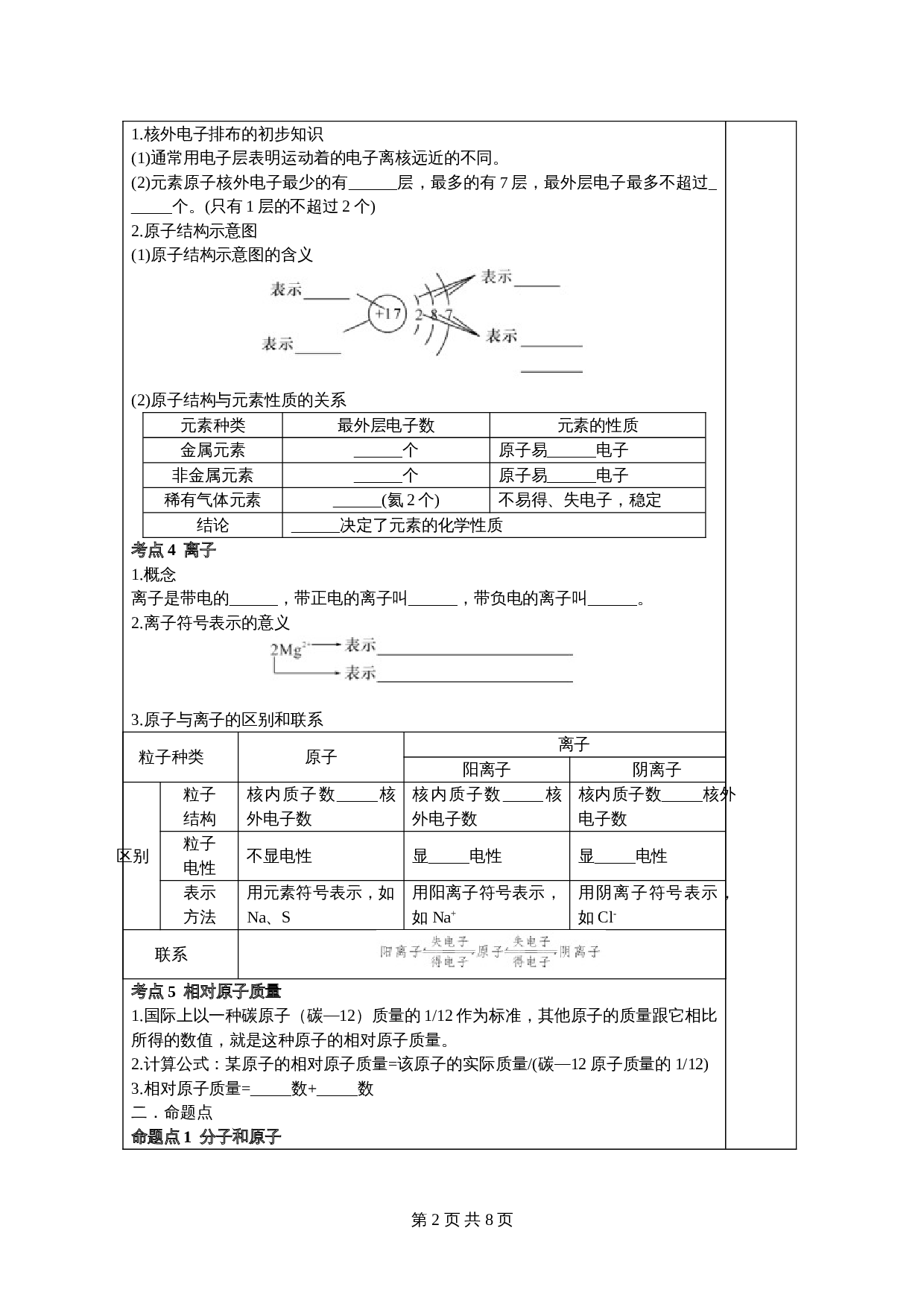
2.原子结构示意图
(1)原子结构示意图的含义
表示
表示
表示
(2)原子结构与元素性质的关系
元素种类
最外层电子数
元素的性质
金属元素
个
原子易
电子
非金属元素
个
原子易
电子
稀有气体元素
(氮2 个)
不易得、失电子,稳定
结论
决定了元素的化学性质
考点4 离子
1.概念
离子是带电的
,带正电的离子叫
,带负电的离子叫
2.离子符号表示的意义
2Mg
表示
*表示
3.原子与离子的区别和联系
离子
粒子种类
原子
阳离子
阴离子
粒子
核内质子数
核
核内质子数
核「核内质子数
核外
结构
外电子数
外电子数
电子数
粒子
座别
不显电性
显电性
显
_电性
电性
表示
用元素符号表示,如
用阳离子符号表示,
用阴离子符号表示
方法
Na、S
如 Na*
如 CI-
联系
阳离子
一阴离子
得电子
得电子
考点5相对原子质量
1.国际上以一种碳原子(碳一12)质量的1/12作为标准,其他原子的质量跟它
人教版化学九年级一轮复习 物质的构成复习教案